Предыдущая Следующая
 354 Глава 6. Технические приложения фрактальной физики
Оказалось, что эти связи температуры и энтропии имеют свою значимость при определении перехода второго рода, т. е. перехода в сверхпроводящее состояние. Так как возникновение сверхпроводимости можно рассматривать как фазовый переход от менее к более упорядоченному состоянию, то были обоснованы условия возникновения сверхпровдимости вблизи точек перехода:
— наличие электронной упорядоченности соединения;
— наличие потенциала притяжения электронов и
— появление критической температуры перехода химического соединения.
Электронная упорядоченность обусловливается подбором элементов с учетом положения каждого атома в элементарной ячейке.
Наличие потенциала притяжения электронов обусловливается подбором элементов по их энергетическим характеристикам, определяющим максимальную энергию связи компоненты в соединении.
Критическая температура перехода в сверхпроводящее состояние определяется наличием в кристаллической структуре ион-молекул, например, 022', возникающих вследствие пространственного ограничения в элементарной ячейке соединения и обусловленных взаимодействием непосредственно ие связанных между собой атомов. Тепловое движение является причиной скачкообразного изменения расстояния между иои-молекулами, вследствие чего обмен энергией между валентными электронами сверхпроводящей системы нарушается, так как потенциал притяжения электронов приобретает хаотическое движение.
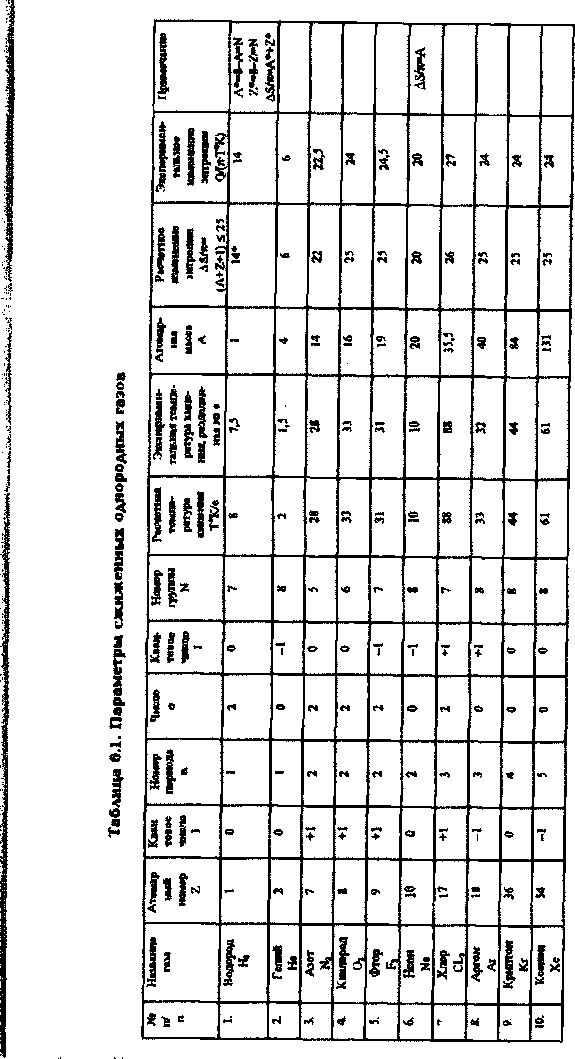
Следовательно, критическая температура Т перехода в сверхпроводящее состояние выражается в градусах Кельвина следующим соотношением [78], которое установлено прн исследования фазовых переходов первого рода:
6.1. Температура и энтропия фазовых переходов 355
Т = е \Ъ + I + (п° + I) Щ , (6.1)
где е - значение числа, выраженное в К.см и равное 2,718... К • см; Ъ - атомный номер характеризует заряд ядра элемента (число протонов); I — квантовое число ( + 1, 0, -1), характеризующее изменение состояния. Изменение состояния вызвано поглощением или излучением атомом кванта энергии; п — номер внешнего энергетического уровня атома определяется номером пе -риода, в котором находится элемент; о — число атомов в молекуле; 3 - квантовое число ( + 1, 0, -1), характеризующее изменение энергетического уровня электрона; N — число внешних электронов атома, равное номеру группы периодической таблицы элементов.
Предыдущая Следующая
|